Los mecanismos enzimáticos individuales se han deducido mediante una diversidad de métodos, que incluyen experimentos cinéticos, estudios estructurales de proteínas y análisis de reacciones con modelos no enzimáticos. Los resultados de esos estudios indican que la extraordinaria capacidad catalítica de las enzimas se debe a propiedades físicas y químicas sencillas, especialmente el enlazamiento y la colocación adecuada de los sustratos en los sitios activos de las enzimas. Se han combinado la química, la física y la bioquímica para esclarecer gran parte del misterio de las enzimas, y la tecnología del ADN recombinante ahora permite probar las teorías propuestas por los químicos de enzimas. Observaciones que sólo hace medio siglo no tenían explicación, ahora se comprenden en su totalidad. Los mecanismos de muchas enzimas están bien establecidos y dan un cuadro general del funcionamiento de las enzimas como catalizadores. Se comenzará este capítulo con un repaso de los mecanismos químicos sencillos, y se seguirá con una breve descripción de la catálisis.
Los cuatro modos principales de catálisis enzimática son catálisis ácido-base y catálisis covalente (modos químicos), así como proximidad y estabilización del estado de transición (modos de enlazamiento). Los detalles de las reacciones a nivel atómico se describen con mecanismos de reacción, que se basan en el análisis de experimentos cinéticos y en las estructuras de las proteínas.
Para cada paso en una reacción, los reactivos pasan por un estado de transición. La diferencia de energía entre los reactivos estables y el estado de transición es la energía de activación. Los catalizadores permiten que las reacciones sean más rápidas al bajar la energía de activación.
Los residuos de aminoácido ionizables en los sitios activos forman centros catalíticos. Estos residuos pueden participar en la catálisis ácido-base (adición o eliminación de protón) o en la catálisis covalente (unión covalente de una parte del sustrato a la enzima). Los efectos del pH sobre la velocidad de una reacción enzimática pueden indicar cuáles residuos participan en la catálisis.
Las velocidades catalíticas de unas cuantas enzimas son tan altas que se acercan al límite físico superior de las reacciones en solución, que es la velocidad con la que se acercan los reactivos entre sí debido a la difusión. La mayor parte del aumento de velocidad que produce una enzima se debe a la unión de los ligandos reaccionantes a la enzima. El efecto de proximidad es el aumento de la velocidad de reacción debido a la formación de un complejo ES no covalente, que reúne y orienta a los reactivos causando una disminución de la entropía.
Una enzima se une con bastante debilidad a sus sustratos. Un enlace demasiado fuerte estabilizaría al complejo ES y haría más lenta la reacción.
Una enzima se une a un estado de transición con mayor afinidad que con la que se une a sus sustratos. La evidencia de la estabilización del estado de transición se obtiene con análogos de estado de transición, que son inhibidores enzimáticos, y también por estudios de anticuerpos catalíticos. Algunas enzimas, en especial las cinasas, usan ajuste inducido (activación inducida por el sustrato, donde interviene un cambio de conformación) para evitar el desperdicio de un sustrato reactivo por hidrólisis.
El mecanismo propuesto para la lisozima, una enzima que cataliza la hidrólisis de paredes celulares bacterianas, incluye distorsión del sustrato y estabilización de un oxocarbocatión intermedio.
Muchas serina proteasas son sintetizadas en forma de zimógenos inactivos que se activan fuera de la célula, bajo condiciones adecuadas, por proteólisis selectiva. El examen de serina proteasas con cristalografía de rayos X muestra cómo las estructuras tridimensionales de las proteínas pueden revelar información acerca de los sitios activos, incluyendo la unión con sustratos específicos.
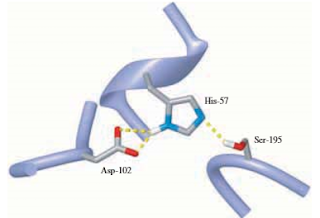
Los sitios activos de las serina proteasas contienen una tríada catalítica Ser-His-Asp. El residuo de serina sirve como catalizador covalente, y el residuo de histidina sirve como catalizador ácido-base. Los compuestos intermedios tetraédricos aniónicos se estabilizan por puentes de hidrógeno con la enzima.


No hay comentarios:
Publicar un comentario