Las proteínas
Las cadenas polipeptídicas no sólo son lineales sino que también están dobladas en formas compactas que contienen espirales, regiones en zigzag, giros y asas. Durante los últimos 50 años se han determinado las formas tridimensionales o conformaciones de más de mil proteínas. Una conformaciónes un ordenamiento espacial de átomos que depende de la rotación de uno o varios enlaces. La conformación de una molécula, como la de una proteína, puede cambiar sin que los enlaces covalentes se rompan, mientras que las diversas configuraciones de una molécula sólo se pueden cambiar si se rompen y vuelven a unir enlaces covalentes.
Las proteínas tienen diversas formas. Muchas son macromoléculas aproximadamente esféricas, hidrosolubles y compactas cuyas cadenas polipeptídicas están dobladas de manera apretada
- Las proteínas globulares tienen un interior hidrofóbico y una superficie hidrofílica, en forma característica. Poseen penetraciones o fisuras que reconocen en forma específica a otros compuestos y se unen a ellos en forma transitoria. Al enlazarse selectivamente con otras moléculas, dichas proteínas sirven como agentes dinámicos de la acción biológica
- Las proteínas fibrosas son una clase particular de proteínas estructurales que proporcionan soporte mecánico a las células u organismos. En el caso típico, las proteínas fibrosas se ensamblan en grandes cables o hebras.
Hay cuatro niveles de estructura de las proteínas
La estructura primaria describe la secuencia lineal de residuos de aminoácidos en una proteína. Recuérdese que las secuencias de aminoácidos siempre se escriben desde el amino terminal (N-terminal) hasta el carboxilo terminal C- (C-terminal). La estructura tridimensional de una proteína se describe con tres niveles adicionales: estructura secundaria, estructura terciaria y estructura cuaternaria. Las fuerzas que mantienen, o estabilizan, estos tres niveles son no covalentes, de manera primordial.
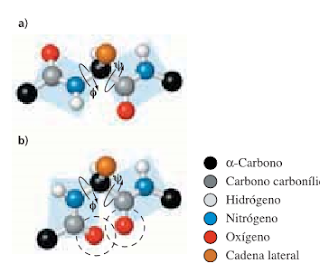 Rotación de los enlaces N-Cα y Cα -C
Rotación de los enlaces N-Cα y Cα -C
La estructura secundaria se refiere a las regularidades en las conformaciones locales mantenidas por puentes de hidrógeno entre los hidrógenos de amida y los oxígenos de carbonilo en la columna vertebral del péptido. Las estructuras secundarias principales son las hélices a y las hebras b (incluyendo las láminas a). Se acostumbra representar las regiones helicoidales a con dibujos que muestran las estructuras de proteínas plegadas; las hebras b se representan con flechas anchas que apuntan desde la dirección N-terminal hacia la C-terminal.
- En las hebras β y laminas β pueden ser: lamina β paralelas o lamina β antiparalela.
La estructura terciaria describe la cadena polipeptídica totalmente plegada y compactada. Muchos polipéptidos plegados consisten en varias unidades distintas unidas por un tramo corto de residuos de aminoácidos, como se ve en la figura 4.1c; a dichas unidades se les conoce como dominios. Las estructuras terciarias se estabilizan por las interacciones de cadenas laterales de aminoácidos en regiones no vecinas de la cadena polipeptídica. La formación de la estructura terciaria acerca partes lejanas de las estructuras primaria y secundaria.
- Dominios. Unidades compactadas, discretas, plegadas en forma independiente.
Algunas proteínas poseen estructura cuaternaria, que implica la asociación de dos o más cadenas polipeptídica en una multisubunidad, o proteína oligomérica u oligómera. Las cadenas polipeptídicas de una proteína oligómera pueden ser idénticas o distintas.
La técnica acostumbrada para determinar la conformación tridimensional de una proteína es la cristalografía con rayos X.
Estructura de las proteinas
Suplementos alimenticios con proteínas
AMEJORVER JUNIOR 30 CAPSULAS MASTICABLES
- Ideado para complementar las necesidades diarias de omega 3, y vitaminas, así como luteína y zeaxantina.
- El aporte suficiente de estos componentes, favorece el estado saludable de la visión.
- No recomendado para menores de 3 años
- Ideado para complementar las necesidades diarias de omega 3, y vitaminas, así como luteína y zeaxantina.
- El aporte suficiente de estos componentes, favorece el estado saludable de la visión.
- No recomendado para menores de 3 años
 MODO DE EMPLEO
MODO DE EMPLEOCantidad diaria recomendada: 1 cápsula al día
Tomar 1 cápsula al día, preferiblemente por la mañana. Se puede ingerir directamente o chupar hasta que se disuelva en la boca y tragar.
ADVERTENCIAS
Los complementos alimenticios no deben utilizarse como sustitutos de una dieta variada y equilibrada y por un modo de vida sano. No superar la dosis diaria recomendada. Mantener fuera del alcance de los niños. Contiene derivados de pescado. Contiene polioles. Su consumo excesivo puede producir efectos laxantes.
No recomendado para menores de 3 años.
COMPOSICIÓN
Ingredientes: Aceite de pescado (Omega-3, 70% DHA), Almidón de maíz, Luteína, Almidón de patata, Zeaxantina, Vitamina E (D-alfa-tocoferol), Edulcorante (Xilitol), Emulgente (Glicerilmonoestearato), Aroma (Aroma de frutas), Emulgente (Lecitina de girasol), Capsula (Envoltura (Gelatina y Glicerina), Colorante (Dióxido de titanio), Aroma (Aroma de frutas) y Colorantes (Oxido de hierro negro y Azul brillante FCF) y Acidulante (Ácido cítrico)).
Supportan®
Es un suplemento alimenticio diseñado
especialmente para apoyar las necesidades nutricionales de personas que padecen
cáncer, caquexia, riesgo a desnutrición o con altas necesidades de
proteínas y energía.
•Personas con cáncer sometidas a
radioterapia o quimioterapia, que sufren de:
-Anorexia, desnutrición y
caquexia.
-Disfagia, problemas de deglución
y masticación.
-Obstrucción en el tracto
digestivo superior.
Sugerencias de uso:
•Supportan® puede usarse vía oral o por sonda.•Puede tomarse frío o bien servirse caliente, sin hervir (vía oral). Beba lentamente.
•Se recomienda tomar entre comidas, al menos 60 minutos antes de la misma para evitar una disminución del apetito y ayudar a mantener la ingesta normal y completa de los alimentos.
•Agítese bien antes de usar.
•No es apto para niños menores a 1 años.
Tamaño de sonda recomendada:
-Alimentación por gravedad Sonda mayor o igual a 8 fr.
-Alimentación por bomba de infusión Sonda mayor o igual a 5 fr.








